Schlüsselerkenntnisse
- Die Markteinführung eines neuen Arzneimittels ist ein extrem kostspieliger und zeitaufwendiger Prozess
- KI-Tools wie ProGen und AlphaFold bieten enormes Potenzial, die Entwicklung von Arzneimitteln zu beschleunigen
- KI wird derzeit in fast jeder Phase des Arzneimittel-Entwicklungsprozesses eingesetzt, einschliesslich der Zielmolekül-Identifikation und der molekularen Simulationen, der Vorhersage von Arzneimitteleigenschaften, der Entwicklung noch nie dagewesener Arzneimittelmoleküle und klinischer Studien
Auf der Global Technology Conference von Nvidia im März 2024 skizzierte CEO Jensen Huang eine kühne Vision für die Rolle von künstlicher Intelligenz (KI) im Gesundheitswesen: „Zum allerersten Mal in der Geschichte der Menschheit hat die Biologie die Möglichkeit, eine Ingenieur-Disziplin zu sein und nicht Wissenschaft .“1 Einige Monate später, im Mai, veröffentlichte Googles DeepMind AlphaFold 3 – das genaueste KI-Modell zur Vorhersage der Proteinstruktur und der bisher entwickelten biomolekularen Wechselwirkungen.2 Einige Forscher/innen glauben, dass es die strukturbiologische Forschung demokratisieren und die Arzneimittelforschung revolutionieren wird.3
Herausforderungen bei der Entwicklung von Arzneimitteln
Arzneimittelentwicklung ist traditionell ein langwieriger und teurer Prozess, der viel Aufwand erfordert. Es dauert oft ein Jahrzehnt und kostet Milliarden von Dollar – investiert in erfolglose klinische Studien, – um ein Arzneimittel aus einem Labor auf den Markt zu bringen. Der Einsatz von KI kann dazu beitragen, den Prozess effizienter zu gestalten, da er zunehmend in jeden Entwicklungsschritt bei neuen Arzneimitteln eingesetzt wird: von der Zielerkennung und dem Finden der Leitsubstanz bis hin zu klinischen Studien.
Auf der Suche nach krankheitsassoziierten Zielmolekülen
Die Arzneimittelentwicklung beginnt mit der Auswahl des richtigen Zielmoleküls – in der Regel ein Protein, das direkt mit einer Krankheit assoziiert ist. Tausende von Zielmolekülen wurden mit biologischen oder biochemischen Methoden entdeckt; einige von ihnen haben die Medizin revolutioniert, zum Beispiel, die Entdeckung des PD-1-Signalweges führte zur Entstehung von PD-1-Checkpoint-Inhibitoren, einem Meilenstein in der Krebs-Immuntherapie.
Trotz der beeindruckenden Anzahl der bisher entdeckten Arzneimittel-Zielproteine wird geschätzt, dass – angesichts des derzeitigen Verständnisses der Genotyp-Phänotyp-Beziehungen und der verfügbarenModalitäten – nur etwa 5% bis 15% dieser Zielmoleküle krankheitsassoziiert sind, d.h. durch Arzneimittel therapeutisch moduliert werden können.4 KI könnte helfen, diese Lücke zu schließen, indem sie riesige genomische Datenbanken analysiert und neue biologische Erkenntnisse über molekulare Wege oder genetische Verbindungen hervorbringt. Dies kann zur Entdeckung neuer oder besserer Zielmoleküle für die Arzneimittelentwicklung führen. AstraZeneca nutzt zum Beispiel ein großangelegtes Gen-Editing-Screening, um Gene in Genomen zu modifizieren und nach phänotypischen Ergebnissen zu suchen, die die gewünschten Arzneimittelwirkungen auf Zellen, Gewebe, Organe und den gesamten Körper nachahmen.5
Neue Modalitäten und Moleküle
Sobald das Zielmolekül identifiziert ist, besteht der nächste Schritt darin, ein Molekül zu finden, das mit diesem eine Bindung bildet. Wenn die Oberfläche eines Proteins zu glatt ist und keine Taschen hat, ist es schwierig für Arzneimittel, eine Bindung zu bilden. Ein weiteres Problem könnte sein, dass das identifizierte Zielmolekül zwar tatsächlich als Bindeglied zwischen anderen Proteindomänen dienen kann, denen komplexe Mechanismen zugrunde liegen, die wir immer noch nicht sehr gut verstehen. Diese Zielmoleküle werden als „nicht krankheitsassoziiert“ angesehen.
In den vergangenen Jahren wurden neue Modalitäten entwickelt, um „nicht krankheitsassoziierte“ Proteine wie Antikörper, Zell- und Gentherapien, Peptide, PROTACs (Proteolysis-Targeting Chimeras), um nur einige zu nennen, ins Visier zu nehmen. Mithilfe von Computersimulationen kann KI den Prozess der Auswahl von Leitmolekülen verbessern, indem sie die Eigenschaften dieses Moleküls viel präziser vorhersagt. Wenn kein gewünschtes Molekül verfügbar ist, können KI-Modelle jetzt Moleküle entwerfen, die in der Natur noch nie gesehen wurden, und sie mit gewünschten pharmakologischen Eigenschaften ausstatten.
Dekodierung der Sprache von Proteinen zur Verbesserung ihrer Eigenschaften
Proteine haben ihre eigene (Programmier-)Sprache. Wie Forscher/innen treffend formulierten, „können Proteinsequenzen als eine Verkettung von Buchstaben aus einem chemisch definierten Alphabet, den natürlichen Aminosäuren, beschrieben werden, und wie in menschlicher Sprache ordnen sich diese Buchstaben und bilden sekundäre Strukturelemente („Wörter“), die sich zu Domänen („Sätzen“) zusammensetzen, die wiederum eine Funktion („Bedeutung“) übernehmen.“6
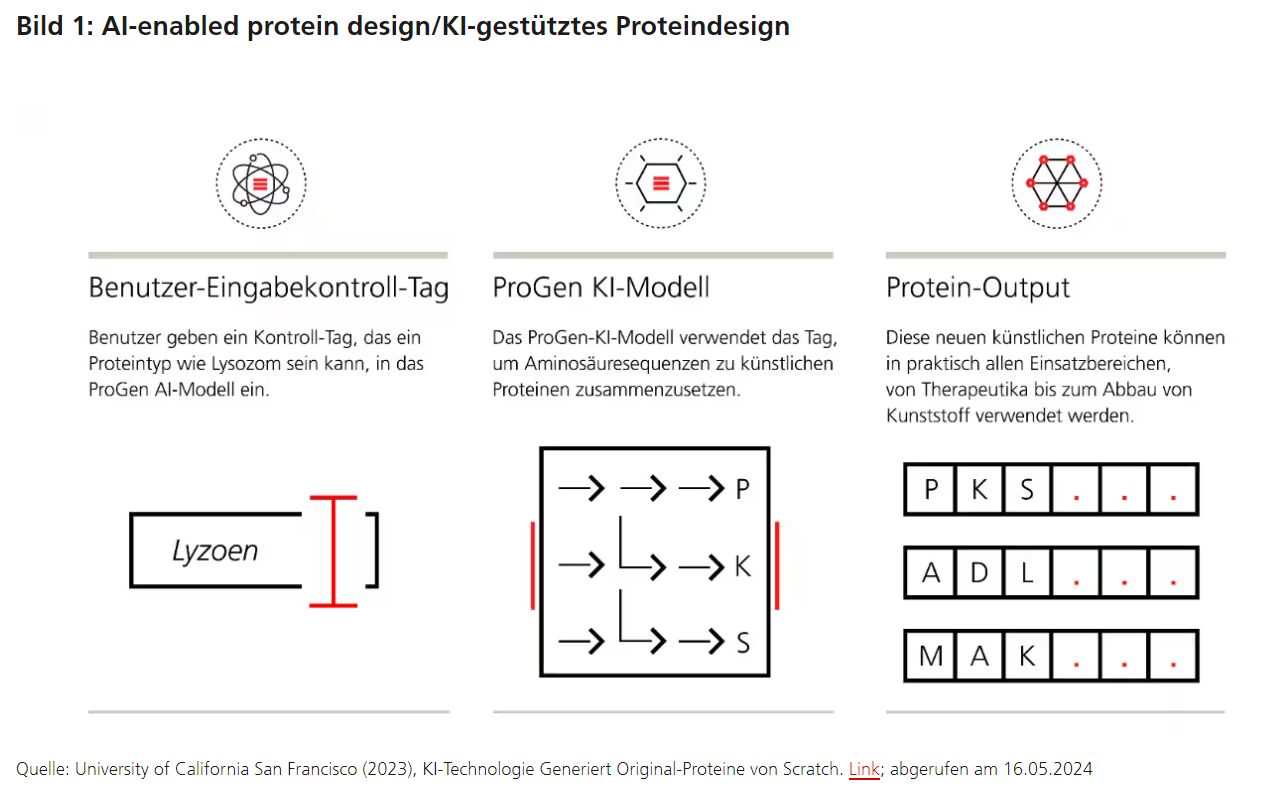
Mittels natürlicher Sprachverarbeitung (maschinelles Lernen, um die Struktur und Bedeutung von Sprachdatensätzen aufzudecken) ist es nun möglich, Proteine so "im Rückwärtsgang zu entwickeln", dass sie spezifische Eigenschaften und Funktionen haben. KI-Programme wie das ProGen von Salesforce sind in der Lage, Aminosäuren-Sequenzen zu künstlichen Proteinen zusammenzufügen, die in der Natur nicht existieren, wenn sie zum Beispiel angewiesen werden, ein Protein mit spezifischen Eigenschaften wie „weniger Nebenwirkungen“ zu finden.
ProGen und AlphaFold helfen bei der Entwicklung neuer Proteine
ProGen „lernte“ die Proteinsprache, die auf einer Datenbank von Aminosäuren in Hunderten von Millionen von verschiedenen Proteinen basiert. Die künstlichen Proteine sind "grammatisch und semantisch" naturalistisch und weisen starke Bioaktivitäten auf, so die Forscher/innen.7 Ein weiteres KI-Programm, AlphaFold, kann die 3D-Struktur eines Proteins aus seiner Aminosäuresequenz vorhersagen. Interessanterweise fanden Forscher/innen heraus, dass „künstliche Entwürfe viel besser abschneiden als solche, die vom evolutionären Prozess inspiriert sind“.
KI verbessert Design und Durchführung klinischer Studien
Die Integration von KI in klinische Studien kann deren Effizienz erheblich verbessern und den Gesamtprozess beschleunigen. KI kann elektronische Krankenakten und andere Patientendaten analysieren, um potenzielle Kandidaten zu identifizieren. Biosimulationsmodelle nutzen die Mustererkennung, um die Dosierung zu optimieren, Arzneimittelwechselwirkungen vorherzusagen und die Wirksamkeit von Arzneimitteln zu bestimmen. Zudem hat sich KI als hervorragendes Instrument bei regulatorischen Fragen erwiesen, wenn Medikamente die Zulassung durch Regulierungsbehörden durchlaufen.
Moderna, das Biotech-Unternehmen, das für die Entwicklung eines der COVID-19-Impfstoffe bekannt ist, hat 750 GPTs8 entwickelt, um interne Aufgaben und Prozesse zu erleichtern. Modernas CEO Stephane Bancel setzt große Hoffnungen auf KI: „… wir nutzen sie in großem Ausmaß, um alle Geschäftsprozesse von Moderna neu zu erfinden, in der Wissenschaft, im Recht, in der Fertigung – überall.“9
Der Begriff Modularität in der Biologie
Das Aufkommen von Technologien wie der genomischen Sequenzierung und den nachfolgenden Geneditierungstools lässt Biologie konzeptionell einer Ingenieur-Disziplin ähneln. Aus dieser Perspektive werden Nukleotide zu DNAs, Aminosäuren zu Proteinen, Proteinen zu Zellen und Zellen zu Organen zusammengesetzt. Stellen Sie sich vor, jedes Biologie-Modul – unabhängig von seiner Größe – hat unterschiedliche Eigenschaften und Funktionen. Können wir, sobald diese Module vollständig verstanden sind, Biologie zusammenbauen, so wie wir Lego aufbauen?
Von der Biologie zum Ingenieur
Wenn auch zu einem noch frühen Zeitpunkt, hat KI bereits vielversprechende Ergebnisse geliefert. Sie wurde erfolgreich in verschiedenen Stadien der klinischen Studien in der Arzneimittelentwicklung eingesetzt, hat uns geholfen, die menschliche Biologie zu verstehen, neue Moleküle geschaffen und sogar klinische Studien entworfen. Das Potenzial von KI wird nur wachsen, wenn es weiterhin auf ständig wachsende Datensätze geschult wird. Die wahre Wirkung von KI wird erst zutage treten, wenn KI-entwickelte Arzneimittel klinische Studien erfolgreich abschließen. Bis dahin könnte die Skepsis anhalten.
Es mag zwar nach Science Fiction klingen, aber die Idee, Biologie in Ingenieurwesen zu verwandeln, ist konzeptionell faszinierend. Für einige KI-Protagonisten steht die Ankunft von AGI (Artificial General Intelligence)10 kurz bevor. Wir haben gute Gründe zu der Annahme, dass das nächste Jahrzehnt für Medizin und Biologie besonders spannend sein könnte und eine Fülle attraktiver Anlagechancen schaffen könnte.
Von Fang Liu (M. A., CFA), Director, Senior Portfolio Manager der Strategie Digital Health Equity der Credit Suisse
Hier finden Sie weitere Informationen.
1. Dean’s Speaker Series (2024). Jensen Huang erklärt, warum die digitale Biologie „eine der größten Revolutionen aller Zeiten“ sein wird. [Videodatei]. Abgerufen von https://www.youtube.com/watch?v=lhdCL-SEwow am 15.5.2024.
2. Nature (2024). Präzise Strukturvorhersage von biomolekularen Interaktionen mit AlphaFold 3. Veröffentlicht am 08.05.2024. Aus Link vom 14.5.2024.
3. Nature (2024). Wichtige AlphaFold Aktualisierung bietet Auftrieb für die Entdeckung von Medikamenten. Veröffentlicht am 08.05.2024. Aus Link vom 10.5.2024.
4. Nature (2023). Jüngste Fortschritte bei der Bekämpfung der „unzerstörbaren“ Proteine: von der Entwicklung von Arzneimitteln bis hin zu klinischen Studien. Veröffentlicht am 6.9.2023. Aus Link vom 3.5.2024.
5. AstraZeneca (2021). Ins Schwarze treffen: Bessere Ziele für die Arzneimittelentwicklung finden. Veröffentlicht am 21.4.2021. Aus Link vom 7.5.2024.
6. Ferruz, N., Schmidt, S., Höcker, B. ProtGPT2 is a deep unsupervised language model for protein design/ist ein tiefes, nicht überwachtes Sprachmodell für Proteindesign. Nat Commun 13, 4348 (2022). https://doi.org/10.1038/s41467-022-32007-7 ProtGPT2 ist ein tiefes, nicht überwachtes Sprachmodell für Proteindesign/ist ein tiefes, nicht überwachtes Sprachmodell für Proteindesign | Nature Communications
7. University of California San Francisco (2023). AI Technology Generates Original Proteins/KI-Technologie erzeugt Original-Proteine von Grund auf. Veröffentlicht am 26.1.2023. Aus Link vom 8.5.2024.
8. GPT steht für „Generative Pre-training Transformer“, eine Art KI-Sprachmodell.
9. The Wall Street Journal (2024). Bei Moderna verändern sich die GPTs von OpenAI Fast Alles. Veröffentlicht am 24.4.2024. Aus Link vom 8.5.2024.
10. Künstliche Allgemeine Intelligenz (AGI) ist eine Art von künstlicher Intelligenz (KI), die bei einem breiten Spektrum kognitiver Aufgaben ebenso gut wie oder besser als Menschen funktionieren kann. McKinsey & Company (2024). What is artificial general intelligence?/Was ist Künstliche Allgemeine Intelligenz?; Published on 21.3.2024. Abgeleitet von Link am 16.5.2024.

